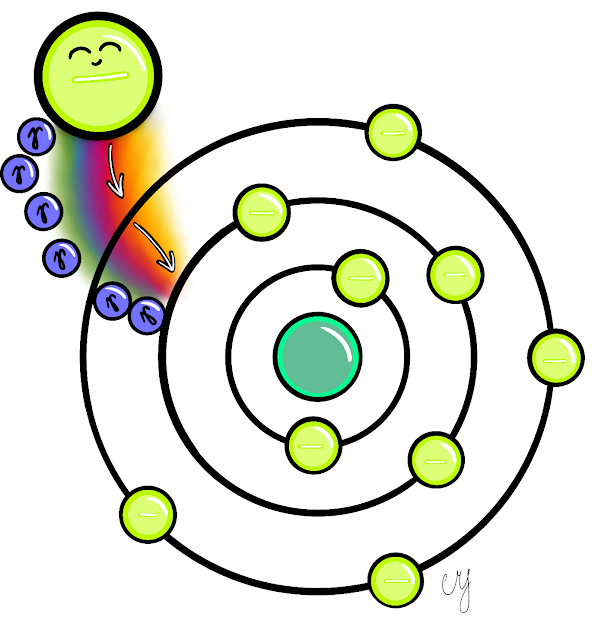
Atom se může nacházet v základním energetickém stavu, pro který je typické, že elektrony v něm mají minimální hodnotu energie nebo mohou dosáhnout stavu excitace. Jak? Pokud atom v základním stavu přijme dostatek energie, může jeho elektron přejít z místa s nižší energetickou hladinou do vyšší. V takovém případě se již jedná o atom excitovaný. Je nadšený.

Pokud přijme ještě více energie, stává se ionizovaným. Je ještě více nadšený. Je jako medik, který udělá zkoušku a pocítí obrovskou vlnu energie a úlevy. Dojde k tomu, že elektron úplně opustí pole (elektrostatické) působnosti jádra daného atomu. Jako medik, když naposledy opouští ústav, kde právě udělal zkoušku.

Ve fyzice se často používá označení kvantum energie, které je atomu dodáno. Kvantum zde můžeme chápat jako nějaké minimální množství něčeho, co vyvolá interakci.
Pro atom je excitace náročná a nevydrží v ní dlouho. Bude mít tendenci k rychlému návratu do základního stavu. Jak to udělá? Je to opačný proces. Elektron, který je ve vyšší energetické hladině sestoupí na nižší energetickou hladinu, přičemž vyzáří kvantum elektromagnetického záření – foton.

Některé excitované stavy se vyskytují s vyšší pravděpodobností a vyznačují se tím, že elektron je schopen v nich setrvat delší dobu. Tento stav se označuje jako metastabilní.
Když atom přechází z metastabilního stavu do základního, dochází k tzv. luminiscenci. Fluorescence je okamžitý děj, kdy látka září téměř ihned po excitaci. Fosforescence naopak trvá déle, protože návrat elektronu do základního stavu je zpomalený

Elektromagnetické záření
Může nabývat všech možných frekvencí, kterým odpovídá určitá vlnová délka. Spektrum elektromagnetického záření je věc čistě popisná. Je potřeba se jednotlivé vlnové délky a jejich význam naučit. Důležité také je, abychom nezapomněli na několik konkrétních věcí.
Jako viditelné záření označujeme elektromagnetické záření o vlnové délce 380 – 750 nm. Vyšším vlnovým délkám odpovídá nižší frekvence a nižší energie.

Každá látka je charakteristická svým absorpčním a emisním spektrem.
Absorpční spektrum je spektrum světla, které daná látka pohlcuje. Nejčastěji excitací svých atomů.
Emisní spektrum je spektrum elektromagnetického záření, které látka vyzařuje.
Látka může záření vyzařovat například přechodem elektronů z vyšší energetické vrstvy do nižší nebo zářením absolutně černého tělesa (každá hmota zahřátá nad 0 K). To znamená, že každá hmota vyzařuje elektromagnetické záření v důsledku nahodilého termického pohybu svých částic.
Emisní spektra atomů v plynném stavu jsou čárová – tvořená úzkými čarami odpovídajícími přesným kvantům energie. Kvantum je nejmenší, již dále nedělitelné množství energie. Dává tedy smysl, že takové množství energie vytvoří jen tenkou čáru. U molekul je to složitější. Energetické hladiny mají charakter pásů. Pásy jsou tvořeny vzájemně se překrývajícími spektrálními čárami, které nelze vzájemně odlišit.

Barbara Galečková